Ley de Boyle Mariotte
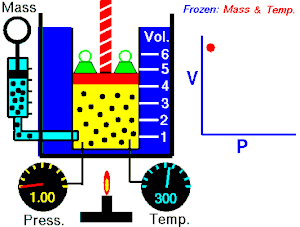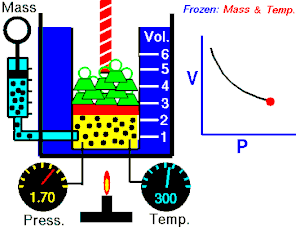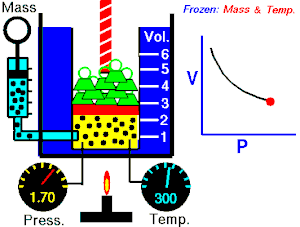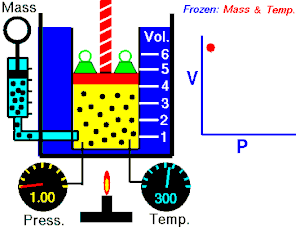

La ley de Boyle-Mariotte, o ley de Boyle, formulada independientemente por el físico y químico anglo-irlandés Robert Boyle (1662) y el físico y botánico francésEdme Mariotte (1676), es una de las leyes de los gases que relaciona el volumen y la presión de una cierta cantidad de gas mantenida a temperatura constante
Al aumentar el volumen, las partículas (átomos o moléculas) del gas tardan más en llegar a las paredes del recipiente y por lo tanto chocan menos veces por unidad de tiempo contra ellas. Esto significa que la presión será menor ya que ésta representa la frecuencia de choques del gas contra las paredes.
Cuando disminuye el volumen la distancia que tienen que recorrer las partículas es menor y por tanto se producen más choques en cada unidad de tiempo: aumenta la presión.
Lo que Boyle descubrió es que si la cantidad de gas y la temperatura permanecen constantes, el producto de la presión por el volumen siempre tiene el mismo valor.
Como hemos visto, la expresión matemática de esta ley es:
P⋅V=kP⋅V=k
(el producto de la presión por el volumen es constante)
Supongamos que tenemos un cierto volumen de gas V1 que se encuentra a una presión P1 al comienzo del experimento. Si variamos el volumen de gas hasta un nuevo valor V2, entonces la presión cambiará a P2, y se cumplirá:
P1⋅V1=P2⋅V2P1⋅V1=P2⋅V2
que es otra manera de expresar la ley de Boyle.

No hay comentarios:
Publicar un comentario